清华新闻网6月8日电 近日,威尼斯9499登录入口药学院教授鲁白、助理研究员郭炜团队成员在生物医学1区杂志《治疗诊断学》(Theranostics)上发表题为“TrkB激活型抗体在阿尔茨海默病治疗中的潜在应用”(Therapeutic potential of a TrkB agonistic antibody for Alzheimer's disease)的论文,报道了一种针对神经退行性疾病的新策略,并基于该策略研发了一款原创抗体药,尝试治疗最具挑战的人类疾病:阿尔茨海默病(AD)。
近年来,研究人员在阐明AD等神经退行性疾病的发病机制方面取得了很大进展。然而,这种基础研究的进展并没有转化为有效的缓解疾病(disease-modifying)治疗手段。以AD为例,近年药物研发聚焦于降低或去除病原毒素(例如Aβ或tau),然而所有这些药物在临床研究中都失败了。严酷的现实迫切要求新的AD治疗策略。
鲁白教授、郭炜博士及其团队成员提出了一种新的AD治疗策略,聚焦于AD疾病发展过程中较晚的病理生理学(pathophysiology),而非过早发生的病理学(pathology)。AD大脑中的一个主要病理生理学特征是突触的丢失以及随后的神经元死亡。鲁白教授团队长期研究证明,脑源性神经营养因子(BDNF)及其受体TrkB是脑内突触可塑性和神经元存活的最重要的调控分子之一。因此,该论文提出通过激活TrkB及其下游信号通路来修复突触并阻止神经元死亡,以达到治疗AD的目的。
在迄今为止研究的所有分子中,BDNF-TrkB信号通路可能是 “突触修复和神经保护”策略的最佳靶点,能够显著促进突触传递、可塑性、生长以及增强神经元存活。然而,BDNF本身的3个特征使其难以成药,因此,几十年来全球药企将BDNF本身开发成药的努力都失败了。
鲁白团队近来开发出了一种能特异性激活TrkB、而不激活p75NTR的抗体AS86,克服了BDNF作为药物的各项缺陷,抗体药物在药代动力学、扩散能力以及特异性上都表现非常突出。
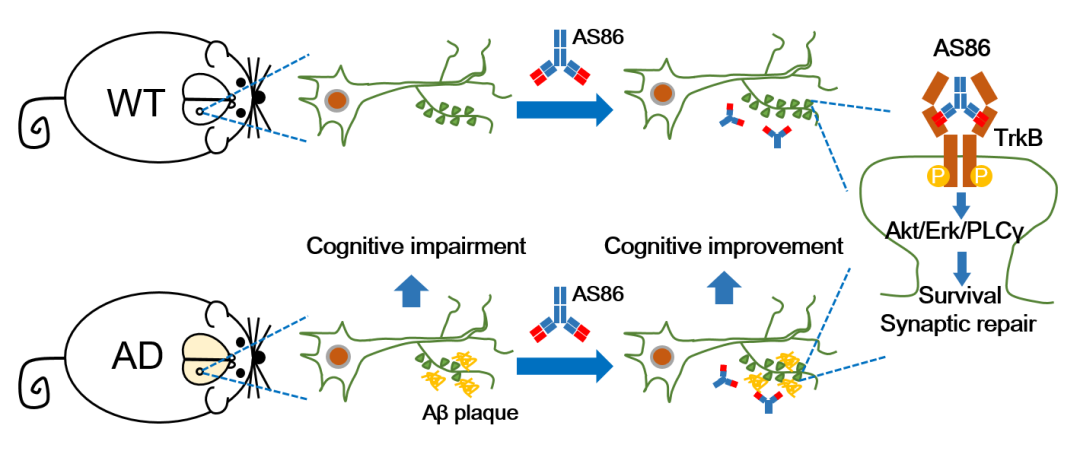
抗体AS86修复突触原理示意图
小鼠体内药效试验验证了AS86能够进入大脑,有效激活药物靶点TrkB,并显著激活海马区TrkB及其下游信号,且在给药2周后脑内还能维持最高剂量的30%。在随后的药效实验中,通过两周一次,连续5个月的小鼠尾静脉注射给药,能够挽救AD小鼠的”新物体识别”记忆缺陷,6个月后显著改善AD小鼠的空间记忆损伤。组织学检测发现AS86能够增加AD小鼠突触小泡蛋白的密度。
因此,研究认定TrkB激活型抗体药物AS86在AD治疗中具有很好的潜力,与清除Aβ的药物联用时能够达到更好的疗效。值得注意的是,AS86并不能减缓Aβ病理发展,突触修复和神经保护才是AS86的核心作用机制。
药学院鲁白教授和助理研究员郭炜为文章的共同通讯作者,课题组博士研究生王书丹为文章的第一作者,其他作者包括课题组的博士生姚虹洋、徐艺华、张雯和刘航;同济大学医学院及同济医院的黄莺教授和郝芮博士是文章的重要合作者。
值得一提的是,鲁白、郭炜团队还在神经疾病领域重要期刊《疾病神经生物学》(Neurobiology of Disease)上发表了另外两篇论文《TrkB激活型抗体较BDNF更具优势:在治疗运动神经损伤的中的应用”(TrkB agonistic antibodies superior to BDNF: Utility in treating motoneuron degeneration)》《“TrkB激活型抗体在缺血性脑损伤中的潜在应用”(Therapeutic potential of a TrkB agonistic antibody for ischemic brain injury)》,详细阐述了TrkB激活型抗体的研发过程,及其分别在运动神经元退化疾病及脑卒中治疗中的潜在应用。
该团队发现,利用TrkB作为酪氨酸激酶受体是通过二聚化激活的特性,研制成TrkB激活型单克隆抗体,使之在成药性上远优于BDNF,并且诱导TrkB激活时间更长。更重要的是,其中一些抗体能够与内源性BDNF发挥协同作用,能够提高运动神经元的存活率。因此,TrkB激活性抗体有望成为治疗运动神经损伤乃至ALS的候选药物。此外,TrkB抗体能够阻止神经元死亡、抑制细胞凋亡和程序性坏死,减小梗死体积和加快感觉运动功能恢复。并且,该抗体也能够激活TrkB及其下游信号,挽救OGD引起的神经元死亡。由于TrkB激活型抗体的上述优秀特征,它也可能成为治疗缺血型脑卒中的潜在药物。
1. Therapeutic potential of a TrkB agonistic antibody for Alzheimer’s disease.
论文链接:https://www.thno.org/v10p6854.htm
2. TrkB agonistic antibodies superior to BDNF: Utility in treating motoneuron degeneration.
论文链接:https://www.sciencedirect.com/science/article/pii/S096999611930258X
3. Therapeutic potential of a TrkB agonistic antibody for ischemic brain injury.
论文链接:https://www.sciencedirect.com/science/article/pii/S0969996119300993
供稿:药学院
编辑:李晨晖
审核:程曦