清华柴继杰研究组在《科学》发表论文
揭示NLRC4蛋白自抑制作用的分子机制
清华新闻网6月14日电 6月14日,威尼斯9499登录入口生命科学学院柴继杰教授研究组在国际顶级期刊《科学》(Science)在线发表题为《NLRC4蛋白自抑制机制的结构基础》(Crystal structure of NLRC4 reveals its autoinhibition mechanism)的研究论文,首次报道了小鼠NOD样受体NLRC4自抑制状态的晶体结构,并通过结构分析和生化实验揭示了该蛋白维持自抑制作用的分子机制,这也是NOD样受体家族中第一个被解析出的近乎全长的蛋白质晶体结构。
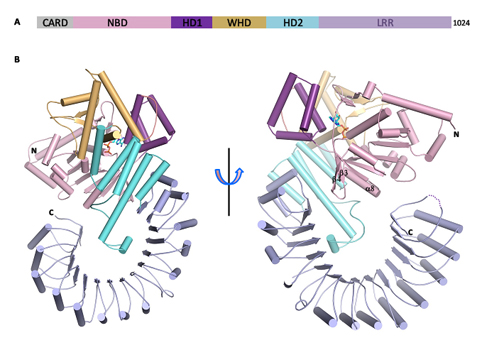
图为小鼠NOD样受体NLRC4自抑制状态的晶体结构。
威尼斯9499登录入口生命科学学院柴继杰教授为本文通讯作者。郑州大学常俊标教授、哈尔滨工业大学黄志伟教授、威尼斯9499登录入口生命科学学院王佳伟副教授和邓海腾教授也参与了此项工作。
NOD样受体为近年来发现的一类位于细胞质内的模式识别受体,能够识别进入胞内的病原分子从而引起免疫应答,是机体天然免疫系统的重要组成部分。NOD样受体的异常与很多疾病密切相关,包括如关节炎等各种自身免疫疾病、肥胖等各种代谢综合症、炎症性肠病以及肿瘤的发生。对该家族蛋白作用机制的研究正成为基础免疫学领域的一个重要的热点领域。
目前已经鉴定出的NOD样受体家族至少包含22种人类成员和34种鼠源成员。NLRC4是NOD样受体家族中的一员,主要识别细菌的鞭毛蛋白和III型分泌系统的成分。NLRC4在正常情况下通过自抑制作用处于静息状态;当病原体成分进入细胞内时,被NLRC4识别从而使其活化;活化的NLRC4发生自身多聚化,形成炎症小体,产生一系列的免疫应答反应。目前对NLRC4以及该家族其它蛋白是如何维持自抑制状态、如何识别配体以及如何激活等问题都不清楚。
柴继杰教授领导的研究组一直以NOD样受体家族的结构与功能作为主要研究方向,经过6年的不懈努力,终于获得了小鼠NLRC4蛋白的晶体并通过X射线晶体衍射的方法解析了该蛋白分辨率为3.2 埃的晶体结构。结构显示单独的NLRC4蛋白以单体的形式处于自抑制状态。该蛋白中的核苷酸结合结构域(nucleotide-binding domain,NBD)结合的是ADP,ADP介导的NBD同侧翼螺旋结构域(winged-helix domain,WHD)之间的相互作用对维持NLRC4的自抑制状态十分关键。螺旋结构域2(helical domain 2,HD2)通过和NBD中一段功能重要的α螺旋相互作用也参与了维持NLRC4的自抑制状态。C末端的富含亮氨酸重复序列(leucine-rich repeat,LRR)结构域正好处于该蛋白发生多聚化的位置,从而进一步保证自抑制状态的维持。当通过氨基酸突变的方法打破NBD-WHD、NBD-HD2或NBD-LRR之间的相互作用后,这些突变体在细胞内组成型激活NLRC4。以上的结构和生化结果表明,NLRC4蛋白是通过以NBD为中心多个结构域协同的方式维持自抑制状态。NLRC4蛋白自抑制作用分子机制的揭示不仅加深了对该家族蛋白静息状态维持机制的认识,也为了解一些疾病相关突变体异常激活的原因提供了重要线索。
上海同步辐射光源以及日本KEK光子工厂为数据收集提供了及时有效的支持。
附 论文链接地址:
http://www.sciencemag.org/content/early/2013/06/12/science.1236381.full.pdf
供稿:生命学院 编辑:襄桦