清华颜宁研究组在《自然》发表论文揭示PPR蛋白特异识别单链RNA的分子机制
清华新闻网10月28日电 10月27日,威尼斯9499登录入口医学院教授颜宁研究组在《自然》在线发表了题为Structural basis for the modular recognition of single-stranded RNA by PPR proteins(PPR蛋白特异识别单链RNA的结构生物学基础)的论文,在世界上首次报道了PPR蛋白特异识别单链RNA的分子机制。威尼斯9499登录入口生命科学学院博士后殷平以及博士研究生李泉秀为该论文共同第一作者。
PPR(pentatricopeptide repeat)蛋白是广泛分布于各类生物当中一大类蛋白家族,在高等植物叶绿体和线粒体当中尤其种类丰富,比如拟南芥和玉米中各有四百多种PPR蛋白。PPR蛋白对单链RNA具有序列特异性识别模式,与RNA的转录、剪切、编辑、和稳定性等过程都密切相关,因为与包括多种农作物在内的植物细胞质雄性不育有直接联系而受到重视。在人类中,PPR蛋白在包括导致Leigh综合症在内的众多生理和病理过程中发挥重要作用。
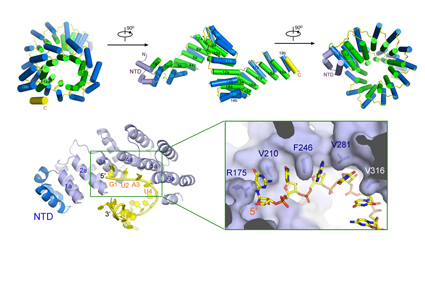
图示为PPR蛋白晶体结构以及对RNA的特异性识别。
PPR蛋白的RNA结合模式与已知的RNA结合蛋白均不同。PPR蛋白由多个PPR重复单元组成,大多数情况下,一个经典的PPR重复单元含有35个氨基酸,每一个重复单元可以特异性地识别一个RNA碱基,近两年的生物信息学和初步生物化学研究研究显示PPR模块与RNA序列有特异的对应关系,但其识别机理及识别密码尚不明确。揭示PPR蛋白特异识别RNA碱基的分子机制对于理解PPR蛋白的工作机理以及促进PPR蛋白生物技术领域的应用具有重要意义。
颜宁教授研究组与施一公、朱健康、王佳伟、王宏伟等课题组合作,选择源自玉米叶绿体的PPR10蛋白进行了深入的结构生物学和生物化学分析,最终获得了PPR10蛋白在未结合RNA和特异结合靶标PSAJ单链RNA两种状态下的高分辨率晶体结构。结构显示,PPR10包含19个PPR重复单元,每个PPR重复单元均为helix-loop-helix结构,多个重复单元组成两圈右手超螺旋。PPR10-PSAJ的复合体晶体结构则清晰地揭示了PPR蛋白特异性识别RNA碱基的分子机理。特异识别发生于PPR重复单元的第2、5、35位的氨基酸与相对应的RNA碱基,这一结构生物学发现为破解PPR的RNA识别密码提供了直接的依据。
自然界中有许多具有重复单元构造的蛋白质,其结构与功能的揭示往往可以把这些蛋白质改造为重要的工具蛋白。例如科学家根据TALE蛋白对DNA序列的特异识别,设计组装能够识别任意序列双链DNA的TALEN工具酶,进而对基因组进行改造。TALEN已经在多个物种中获得了广泛应用。这是颜宁课题组与合作者继2012年1月在《科学》报道TALE蛋白识别双链DNA的分子机制后,对重复单元蛋白的又一项结构与功能研究,希望可以促进PPR在生物技术中的应用。
上海同步辐射光源(SSRF)何建华研究员及郁峰博士为数据收集提供了及时有效的帮助,保证了研究组在这一课题上率先取得突破。南开大学龙加福研究组为PPR蛋白的生化性质鉴定提供了重要支持。
供稿:医学院 生命学院 编辑:范 丽